[주]유한테크 홈페이지 방문을 환영합니다.
- 1599-7665
- master@yoohantech.com
고객지원
블로그
가스·누액 감지 설비의 현장 신뢰를 만듭니다
📌 유해화학물질 누액감지기 선정을 위한 핵심 기술 요약
누액감지기의 정확한 작동을 위해서는 감지 대상인 화학물질(무기 용매)의 전기 전도성 특성을 이해하는 것이 필수적입니다. 본 포스팅에서는 ▲물의 자체 이온화 ▲액체 암모니아의 금속성 전도 등 무기 용매의 다양하고 역설적인 전도 메커니즘을 분석하여, 현장에 적합한 고성능 누액감지 센서 선정의 기술적 배경을 제공합니다.

안녕하세요! 오늘은 앞서 다룬 유기 용매와는 대조적으로, 그 성질이 매우 다양하고 때로는 역설적인 무기 용매(Inorganic Solvents)의 전기 전도성 특징을 기술적으로 깊이 있게 탐구해 보겠습니다. 이러한 특성을 이해하는 것은 화학 사고 예방을 위한 정밀한 누액감지기 설치의 기초가 됩니다.
1. 무기 용매의 전도성 스펙트럼과 감지기 적용
무기 용매는 전도성이 극도로 낮은 비극성 용매부터, 전해질을 녹이면 전도성이 폭발적으로 증가하는 극성 용매까지 광범위한 스펙트럼을 가집니다. 이는 누액감지 센서의 타입(전도도 방식 vs 비전도도 방식)을 결정하는 중요한 요소입니다.
| 전도성 등급 | 대표 용매 | 기술적 특징 (누액 감지 포인트) |
| 극고 전도성 | 액체 NH3 (알칼리 금속 용액) | 전자가 직접 전하를 운반 (금속성 전도) - 고감도 센싱 필요 |
| 고전도성 | 물 H2O, 액체 HF | 이온 해리 능력 탁월, 자체 이온화 우수 - 일반 누액감지기로 감지 용이 |
| 비전도성 | CS2, CCl4 | 비극성, 이온 해리 능력 거의 없음 - 특수 유기용제 전용 감지기 필요 |
2. 전도성을 지배하는 두 가지 기술적 요인
무기 용매의 전도성을 결정하는 핵심은 유기 용매와 마찬가지로 이온의 생성과 이동성입니다. 이는 누액감지기가 누출 신호를 포착하는 속도와 직결됩니다.
1. 자체 이온화 및 이온 전달 메커니즘 (Proton/Solvent Jump)
극성 무기 용매, 특히 **양성자성 용매(Protic Solvents)**는 자체적으로 이온화되어 전하 운반자를 생성합니다. 가장 대표적인 예가 물입니다.
-
물의 자체 이온화: H2O + H2O ⇔ H3O+ + OH-
-
고유 전도도: 순수한 물의 고유 전도도는 이 반응으로 생성된 이온 농도( [H3O+] = [OH-] ≈ 10-7M)에 의해 결정되며, 매우 낮습니다 (0.055µS/cm).
-
Grotthuss 메커니즘: 물이 전해질 용액에서 전도성이 높아지는 것은 단순한 이온 이동(Ion Mobility) 외에도, 양성자가 수소 결합 네트워크를 따라 빠르게 '점프'하며 이동하는 그로투스 메커니즘(Grotthuss Mechanism) 덕분입니다. 이로 인해 H+ 이온의 유효 이동 속도가 빨라 누액 발생 시 감지 반응 속도가 매우 빠릅니다.
2. 극도의 이온 해리 능력 (High Dielectric Constant, εr)
물(εr ≈ 80)과 같은 극성 무기 용매는 매우 높은 유전 상수를 가집니다.
-
쿨롱 상호작용 약화: 높은 εr 값은 용질 내 이온 간의 정전기적 인력(F)을 극도로 약화시켜, 이온성 염(Ionic Salt)을 효율적으로 자유 이온으로 분리(해리)합니다.
-
용매화(Solvation): 또한, 극성 무기 용매 분자들은 이온 주변을 안정적으로 둘러싸는 매화 껍질(Solvation Shell)을 형성하여 이온의 재결합을 막고 안정적인 이동을 보장합니다. 이는 화학 감지 센서의 신뢰성을 높여줍니다.
3. 특이한 전도성 메커니즘을 가진 무기 용매
일부 무기 용매는 일반적인 이온 전도와는 차별화되는 흥미로운 현상을 보입니다.
1. 액체 암모니아 (NH3)의 금속성 전도 (Metal-like Conduction)
액체 암모니아는 알칼리 금속(예: Na, K)을 녹일 수 있습니다. 이 용액은 낮은 농도에서는 이온 전도성을 보이지만, 특정 농도(≈ 3M) 이상이 되면 용해된 전자가 용매화되어 자유롭게 움직이는 용매화 전자(Solvated Electrons)를 형성합니다.
-
반응:
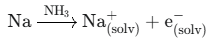
-
결과: 이 용액은 금속처럼 높은 전도성을 띠게 되며, 색깔이 파란색에서 청동색으로 변하는 놀라운 현상을 보입니다. 이는 전하 운반자가 이온이 아닌 자유 전자이기 때문에 나타나는 현상입니다.
2. 비극성 무기 용매의 절연 특성
반면, 이황화탄소(CS2)나 사염화탄소(CCl4)와 같은 비극성 무기 용매는 이온을 해리시키지 못하고 자체 이온화도 미미하여 유기 용매의 비극성 용매와 마찬가지로 비전도성(절연체)을 가집니다. 이러한 물질은 일반적인 전도도 누액감지기로는 감지가 불가능하므로 비전도성 유기용제 전용 센서를 사용해야 합니다.
4. 무기 용매의 첨단 활용: 비수계 전해액과 안전 관리
화학 및 재료 과학에서 무기 용매의 전도성 특성은 비수계(Nonaqueous) 시스템에 활용됩니다. 리튬 배터리처럼 물을 사용할 수 없는 시스템에서, 무기 용매는 초강산(HF, H2SO4 등)과 함께 연구되거나, 극성 유기 용매와의 조합을 통해 고성능 전해액을 설계하는 데 핵심적인 역할을 합니다.
궁극적으로, 무기 용매의 전도성은 그 용매가 얼마나 효율적으로 이온을 생성하고 이동시키는지에 달려 있으며, 이는 첨단 에너지 저장 장치 개발 및 정밀 화학 누액감지기 시스템 구축의 기초가 됩니다.
![]()
🌌 액체 암모니아(NH3)의 흥미로운 전도성 메커니즘
액체 암모니아(NH3)는 물과 유사한 극성 무기 용매이지만, 여기에 알칼리 금속(Li, Na, K)이 용해될 때 나타나는 전도성 메커니즘은 다른 용매에서는 찾아볼 수 없는 매우 특이하고 흥미로운 현상입니다.
1. 전도성 변화의 이중성: 이온 전도 vs. 전자 전도
액체 암모니아 용액의 전도도는 용해된 알칼리 금속의 농도에 따라 급격하게 변화하며, 두 가지 메커니즘을 보여줍니다.
A. 저농도 구간 (Low Concentration): 이온 전도성 (Ionic Conduction)
알칼리 금속을 소량 녹였을 때 (10-3M 이하), 금속은 해리되어 양이온과 전자를 생성합니다.
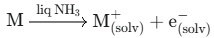
-
용매화 이온 (M+): 알칼리 금속 이온(Na+ 등)은 암모니아 분자(NH3)에 둘러싸여 용매화 이온을 형성하고, 일반적인 전해질처럼 이온의 물리적 이동에 의해 전기를 운반합니다.
-
용매화 전자 (e-): 방출된 전자(e-)는 암모니아 분자들이 만드는 공동(Cavity)에 갇혀 용매화 전자를 형성합니다. 이 전자는 용액에 깊고 푸른색을 부여하며 전하 운반자 역할을 합니다.
-
전도도: 이 구간의 전도도는 이온 및 용매화 전자의 이동성에 의해 결정되며, 여전히 전해액의 특성을 가집니다.
B. 고농도 구간 (High Concentration): 금속성 전도 (Metallic Conduction)
용해된 금속의 농도가 증가함에 따라 (예: 1 ~ 3M 범위), 용액은 비금속-금속 전이(Nonmetal-to-Metal Transition)를 겪으며 전도성이 폭발적으로 증가합니다.
-
전자 결합: 이온과 용매화 전자의 농도가 높아지면, 용매화 전자들이 서로 강하게 상호작용하기 시작합니다.
-
금속성 클러스터: 이 전자들은 더 이상 개별적인 공동에 갇혀 있지 않고, 자유롭게 움직이는 집단적인 전자(Delocalized Electrons) 상태가 됩니다.
-
결과: 용액은 금속과 유사한 성질을 띠게 됩니다.
-
색깔 변화: 깊은 파란색이 반짝이는 청동색 또는 금속성 황금색으로 변합니다.
-
전도도: 전하 운반자가 이온 이동이 아닌 자유 전자 이동으로 바뀌면서 전도도가 극도로 높아집니다 (이는 순수한 액체 금속에 버금가는 수준입니다).
-
2. 기술적 중요성 및 현장 적용
액체 암모니아 용액은 단순한 화학적 호기심을 넘어, 다음과 같은 분야에서 기술적 중요성을 가집니다.
-
환원제 및 반응성: 용매화 전자는 매우 강력한 환원제 역할을 합니다. 이는 산업 현장에서 누출 시 폭발이나 화재의 위험성을 내포하므로 방폭형 누액감지기 설치가 필수적임을 시사합니다.
-
기초 연구: 비금속 물질이 금속적 전도성을 띠게 되는 특이한 현상 덕분에, 응집물리학 및 차세대 화학물질 감지 센서 개발의 모델 시스템으로 활용됩니다.
누액감지기 제품 문의 및 기술 상담
취급 물질 특성과 누액 환경에 따라 감지 가능 여부와 적용 방안을 안내드립니다.
누액 감지 안전 설비의 신뢰 기준을 만듭니다.

이 게시물을
산업 안전 감지·경보 설비의 신뢰 기준을 만듭니다.























