[주]유한테크 홈페이지 방문을 환영합니다.
- 1599-7665
- master@yoohantech.com
고객지원
블로그
가스·누액 감지 설비의 현장 신뢰를 만듭니다
📌 유기용제 전용 누액감지기 선정 기술 가이드
에탄올, 헥산 등 유기 용매는 낮은 유전 상수로 인해 전기가 통하지 않는 비전도성 특성을 가집니다. 따라서 전도도 방식을 사용하는 일반 누액감지기로는 누출 여부를 탐지할 수 없습니다. 본 기술 자료에서는 유기 용매의 화학적 특성을 분석하고, 이를 통해 현장에 적합한 특수 누액감지 센서 선정의 기술적 기준을 제시합니다.

화학과 재료 과학, 그리고 안전한 누액감지기 설치에 관심 있는 분들을 위한 오늘의 주제는 바로 '유기 용매(Organic Solvents)의 낮은 전기 전도성', 즉 비전도성의 특징을 기술적이고 정확하게 파헤쳐 보는 것입니다. 우리가 일상에서 흔히 사용하는 에탄올, 아세톤, 헥산 같은 용매들이 왜 전기를 잘 통하지 않는지, 그 과학적 원리를 알면 올바른 누출 감지 솔루션이 보입니다.
1. 전도성의 기본 원리: 이온과 이동성
어떤 물질이 전기를 통하게, 즉 전도성(Conductivity) 가지려면 두 가지 조건 중 하나를 충족해야 합니다. 일반적인 산/알칼리 누액감지기는 2번 원리를 이용합니다.
-
자유 전자(Free Electrons)의 존재: 금속처럼 전하를 띠는 전자가 격자 사이를 자유롭게 이동할 수 있어야 합니다.
-
이동 가능한 이온(Mobile Ions)의 존재: 용액 내에서 양이온(Cation)과 음이온(Anion)이 자유롭게 움직이며 전하를 운반해야 합니다.
하지만 유기 용매는 이 두 가지 조건 중 어느 것도 충족하지 못하기 때문에 기본적으로 비전도성 물질(절연체, Insulator)로 분류됩니다. 이것이 바로 일반 누액감지기가 유기 용제를 감지하지 못하는 이유입니다.
2. 유기 용매의 비전도성 특징 (기술적 설명)
유기 용매가 전도성이 낮은 주요한 기술적 이유는 그들의 화학적 결합 및 분자 구조적 특성 때문입니다.
1. 낮은 자체 이온화 (Low Autoionization)
대부분의 유기 용매는 공유 결합(Covalent Bonds)으로 이루어진 분자성 물질(Molecular Substances)입니다.
-
이들은 물(H2O)처럼 자체적으로 이온화(Autoionization)되어 전하 운반자(H+, OH-)를 생성할 수는 있지만, 그 정도가 극도로 미미합니다.
-
예를 들어, 에탄올(C2H5OH)의 자체 이온화 반응의 평형 상수(Kauto)는 매우 작습니다 (약 10-20 수준).
-
따라서, 순수한 유기 용매에는 전하를 운반할 수 있는 자유 이온의 농도(Cion)가 거의 0에 가깝습니다.
2. 낮은 유전 상수 (Low Dielectric Constant, εr)
전기 전도도, 즉 누액감지 센서의 작동 여부를 결정하는 가장 중요한 변수 중 하나는 용매의 유전 상수(εr)입니다.
-
유전 상수는 용매가 두 전하(q1, q2) 사이의 정전기적 인력을 얼마나 약화시킬 수 있는지를 나타냅니다.
-
쿨롱의 법칙(
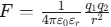 )에 따르면, εr 값이 클수록 인력(F)은 약해집니다.
)에 따르면, εr 값이 클수록 인력(F)은 약해집니다. -
물(H2O)은 εr ≈ 80으로 높지만, 헥산(εr ≈ 2)이나 벤젠 등 유기 용매는 훨씬 낮습니다.
-
결과: 유기 용매는 이온을 자유롭게 분리(해리)시키지 못하므로 전도도가 발생하지 않아 일반적인 감지기로는 누출 신호를 잡을 수 없습니다.
3. 전하 이동 메커니즘의 부재
유기 용매는 금속처럼 전자가 자유롭게 흐르는 밴드 구조가 없으며, 이온 농도 또한 낮아 전하 이동이 거의 불가능합니다.
3. 예외 및 활용: 전해질 첨가
순수한 유기 용매는 비전도성이지만, 산업적으로는 이 특성을 극복하여 활용합니다.
💡 주목: 리튬 이온 배터리(Li-ion Battery)의 전해액이 대표적인 예입니다. 리튬 배터리는 물을 사용할 수 없는 비수계 시스템이므로, 낮은 유전 상수의 유기 용매(카보네이트 계열)에 전해질 염(LiPF6 등)을 고농도로 녹여 강제로 전도도를 만듭니다. 이 경우, 누액감지기는 산성/전도도 감지 방식을 사용할 수도 있습니다.
![]()
🔍 유기 용매의 유전 상수와 전도도 변화 (심화)
유기 용매의 유전 상수(εr)가 전도도에 미치는 영향을 이해하는 것은 전기화학 및 정밀 누액감지기 선정에서 매우 중요합니다.
1. 주요 유기 용매별 유전 상수 (εr) 비교와 센서 선정
유전 상수는 용매의 극성(Polarity)을 나타내며, 이는 감지기 센서 타입(무기용제 센서, 유기용제 센서 등)을 결정짓는 기준이 됩니다.
| 용매 종류 | 유전 상수 (εr) | 누액감지기 적용 포인트 |
| 물(H2O) | ≈ 80 | 일반 전도도 감지기 사용 가능 (물 감지) |
| 에틸렌 카보네이트(EC) | ≈ 90 | 배터리 전해액 성분, 높은 유전율로 이온 해리 유리 |
| 아세톤(Acetone) | ≈ 21.5 | 중간 극성, 특수 유기용제 센서 필요 |
| 벤젠(Benzene) | ≈ 2.3 | 비전도성, 유기용제/비전도식 감지기 필수 |
-
높은 εr: 이온 해리가 잘 되어 전도성이 생길 가능성이 있음.
-
낮은 εr (유기 용매 대부분): 이온 쌍을 형성하여 전도도가 매우 낮음. 따라서 저항 변화를 감지하는 방식이 아닌, 굴절률이나 흡착 방식의 센서를 적용해야 합니다.
2. 전해질 첨가 시 전도도 변화 원리
순수한 유기 용매의 전도도는 미미하지만, 전해질 염(Electrolyte Salt)을 첨가하면 전도도가 급격히 상승합니다.
1. 이온 용해와 전하 운반자 생성
-
용매에 LiPF6와 같은 리튬염을 첨가하면 이온으로 해리됩니다.
-

-
이 생성된 자유 이온들이 누액감지기 전극 사이에서 미세 전류를 형성하여 감지를 가능하게 할 수 있습니다.
누액감지기 제품 문의 및 기술 상담
취급 물질 특성과 누액 환경에 따라 감지 가능 여부와 적용 방안을 안내드립니다.
누액 감지 안전 설비의 신뢰 기준을 만듭니다.

이 게시물을
산업 안전 감지·경보 설비의 신뢰 기준을 만듭니다.























